| 2.3.3
Entzündliche Herzerkrankungen |
|
_____ |
| Definition: Als entzündliche
Herzerkrankungen werden entzündliche Prozesse des Endokards, des Myokards
oder des Perikards bezeichnet. Entsprechend lassen sich Endokarditis, Myokarditis
und Perikarditis unterscheiden. Ist das gesamte Herz betroffen, spricht
man von einer Pankarditis. |
|
|
|
 |
|
|
| 2.3.3.1
Endokarditis |
|
|
Die Endokarditis hat im
wesentlichen zwei Ursachen:
• zum einen können
Erreger,
wie z.B. Bakterien oder Viren (seltener Pilze oder Rickettsien), eine Endokarditis
auslösen,
• zum anderen kann
eine Endokarditis rheumatisch als Folge eines akuten rheumatischen
Fiebers auftreten. |
|
Ursachen |
Die wesentliche Bedeutung
der Endokarditis liegt darin, dass sie die Herzklappen befällt und
dort über entzündliche, später narbige Prozesse zur Ausbildung
von Herzklappenfehlern führen kann. Da diese Herzklappenfehler
im Laufe des Lebens entstehen, werden sie erworbene Herzklappenfehler genannt
und so von den angeborenen Herzfehlern abgegrenzt. Die erworbenen Herzklappenfehler
entwickeln sich zu über 90% infolge einer Endokarditis.
Eine rheumatische Endokarditis
entsteht im Rahmen des sog. akuten rheumatischen Fiebers (ARF). Als ARF
bezeichnet man ein Krankheitsbild, bei dem einerseits ein entzündlicher
Gelenkbefall, andererseits entzündliche Veränderungen an anderen
Organen, vor allem am Herzen (rheumatische Karditis), auftreten. Es handelt
sich um eine nichteitrige Nacherkrankung einer Hals- oder Racheninfektion
mit bestimmten Streptokokken. Nach Organbefall und Häufigkeit lassen
sich beim ARF folgende klinische Syndrome unterscheiden:
• rheumatische Karditis
(20-70%),
• akute rheumatische
Polyarthritis (50-80%),
• Chorea minor (nur
bei Kleinkindern, unter 5%). |
| Der typische Krankheitsverlauf
der meist jungen Patienten stellt sich folgenderweise dar: Zunächst
trat eine Mandelentzündung (Angina) auf. Nach Überstehen der
Angina bestand 1-3 Wochen Beschwerdefreiheit. Dann entwickelten sich plötzlich
Fieber, Gelenkschmerzen und Zeichen einer Karditis. Das ARF tritt
also typischerweise als Zweitkrankheit auf. Die Erst- oder Vorkrankheit
des ARF ist i.d.R. immer ein Streptokokkeninfekt, meist in Form
einer Angina. Dabei handelt es sich stets um Streptokokken der serologischen
Gruppe A. Sie bilden verschiedene Enzyme und Stoffwechselprodukte, z.B.
das Streptolysin und die Streptokinase. Das ARF ist also keine Infektionskrankheit
im engeren Sinne, da die Streptokokken nur in den Tonsillen zu finden sind,
die rheumatische Reaktion an Gelenken und Herz jedoch ohne Anwesenheit
von Bakterien abläuft. Vielmehr handelt es sich um eine infektinduzierte
Autoimmunkrankheit. |
|
Entstehung |
Etwa 10 Tage nach einem
Streptokokkeninfekt tritt plötzlich hohes Fieber (39 bis 40° C)
auf mit Rötung und starker Schmerzhaftigkeit mehrerer, insbesondere
der mittleren und großen Gelenke (Knie-, Fuß-, Finger- und
Zehengelenke). Hochfieberhafte, dramatische Verläufe bilden heute
eher die Ausnahme; ebenso ist in den letzten Jahrzehnten in Mitteleuropa
generell ein erheblicher Rückgang des ARF zu verzeichnen.
Die Weichteile in der Umgebung
der Gelenke sind geschwollen, oft besteht ein Gelenkerguß; histologisch
findet sich als Ausdruck einer spezifischen Entzündung ein typisches
rheumatisches
Granulationsgewebe. Da mehrere Gelenke entzündlich erkrankt sind,
spricht man von Polyarthritis. Die Entzündung kann rasch von
einem zum anderen Gelenk "springen", weshalb das ARF im Volksmund auch
als "fliegende Gliedersucht" bezeichnet wird. Im Herzmuskel, aber auch
in den Sehnenscheiden und Faszien sind knötchenförmige Wucherungen
eines spezifischen rheumatischen Granulationsgewebes nachweisbar, die als
Aschoff-Geipelsche Knötchen bezeichnet werden. Gleichzeitig entwickelt
sich bei Kindern in 60%, bei Erwachsenen in etwa 30% der Fälle eine
rheumatische
Karditis. |
|
Klinisches
Bild |
| Eine rheumatische Karditis
kann sich durch Herzklopfen, Rhythmusstörungen oder Atemnot bemerkbar
machen und ist am sichersten durch EKG, Echokardiografie und Labor nachweisbar.
Die BKS ist stark beschleunigt, im Blutbild fällt eine Leukozytose
mit Linksverschiebung auf. Erhöhte Antistreptolysin-Titer belegen
den zugrunde liegenden Streptokokkeninfekt. Die rheumatische Endokarditis
wird, da sie zu kleinen warzenartigen Auflagerungen an den Herzklappen
führt, auch Endocarditis verrucosa genannt. Die Mitralklappe wird
in 45-60%, die Aortenklappe in 10-15% der Fälle betroffen; in 25-40%
der Endokarditisfälle sind beide Klappen erkrankt. Die Klappen des
rechten Herzens bleiben weitgehend verschont. An der Haut können typische
Veränderungen auftreten: linsen- bis markstückgroße blaurote
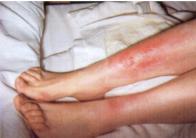
Knoten an der Streckseite der Unterschenkel, das sog. Erythema nodosum. |
|
Diagnose |
|
|
Abb. 13: Erythema
nodosum der Beine bei akutem rheumatischem Fieber
 |
|
Abb.
13 |
|
|
| Eine gefürchtete Komplikation
bei Kleinkindern ist die sog. Chorea minor oder Chorea rheumatica durch
entzündliche und toxisch-degenerative Veränderungen im Gehirn.
Bereits im vorigen Jahrhundert hat der französische Arzt LASÈGUE
mit folgender Feststellung das Wesen des rheumatischen Fiebers erkannt:
"Das rheumatische Fieber beleckt die Gelenke und das Gehirn, aber es beißt
das Herz." |
|
Komplikationen |
| Da jede Streptokokkenangina
zum ARF führen kann, muss sie über 14 Tage mit 1-2 Mill. IE Penicillin
täglich behandelt werden. Beim ARF selbst wird für drei Wochen
1 Mega Penicillin G täglich gegeben. Danach ist eine Rezidivprophylaxe
mit i. m. Injektionen von 1,2 Mega Penicillin G in Retardform bis zum 25.
Lebensjahr erforderlich. Der rheumatische Entzündungsprozess selbst
lässt sich durch hohe Dosen von Salicylaten (z.B. 1 g Acetylsalicylsäure
tägl.) und Prednisolon 1-2 mg/kg Körpergewicht unterdrücken. |
|
Therapie |
| An den Gelenken können
Rückfälle auftreten, es kommt jedoch nicht zu bleibenden Gelenkschäden.
Entscheidend sind die Endokarditisfolgen, denn nicht selten pfropft sich
auf die abakterielle rheumatische Endokarditis eine bakterielle Endokarditis
auf, die über lange Zeit weiterschwelen kann. Die Klappen werden entweder
z.T. entzündlich weggeschmolzen und sind dann schlußunfähig,
was zur Entstehung einer Herzklappeninsuffizienz führt, oder
aber die narbige Schrumpfung führt zur Verengung der Klappe, d.h.
zu einer Klappenstenose. |
|
Folgen |
| Ein Herzklappenfehler nach
rheumatischer Endokarditis entwickelt sich bei Kindern und Jugendlichen
in ca. 70%, bei Erwachsenen in ca. 20% der Fälle. Da 40% der Patienten
mit erworbenen Klappenfehlern eine "leere Anamnese" aufweisen, ist anzunehmen,
dass die rheumatische Karditis häufig klinisch stumm verläuft. |
|
|
| nach oben |
 |
|
|
|
|
| 2.3.3.2 Bakterielle Endokarditis |
|
|
| Definition: Als bakterielle
Endokarditis wird eine Entzündung Herzinnenhaut, vor allem der Herzklappen
bezeichnet, die häufig zu Herzklappenfehlern führt. |
|
|
|
 |
|
|
Zur Ansiedlung von Bakterien
am Endokard und den Herzklappen kommt es praktisch nur, wenn entweder die
Klappen durch eine rheumatische Entzündung vorgeschädigt sind
oder am Herzen Missbildungen (s. Kap. 2.3.5 angeborene Herzfehler) vorliegen.
Die rheumatische Endokarditis bzw. vorbestehende Veränderungen an
den Herzklappen bereiten sozusagen den Boden für die bakterielle Endokarditis
vor. Ein hohes Endokarditisrisiko stellen auch operierte Herzfehler und
Klappenprothesen dar. Die Häufigkeit des endokarditischen Befalls
der einzelnen Herzklappen ist sehr unterschiedlich:
Mitralklappe ca. 75%, Aortenklappe
ca. 55%, Trikuspidalklappe 15%, Pulmonalklappe ca. 1%. Rechtsherzendokarditiden
(Trikuspidalklappe) werden infolge der Verschleppung von infektiösem
Material durch unsterile i. v.-Injektionen v.a. bei Drogenabhängigen
beobachtet.
70% der bakteriellen Endokarditiden
werden durch sog. vergrünende Streptokokken (Streptococcus viridans)
hervorgerufen. Als weitere Erreger kommen mit sinkender Häufigkeit
Staphylokokken, Enterokokken, gramnegative Keime, sehr selten Pneumokokken
und Gonokokken vor. In 20 % der Fälle sind trotz einwandfreier Technik
in der Blutkultur keine Erreger anzüchtbar. Die Erreger gelangen meist
aus Herden in den Tonsillen, Zähnen, Nasennebenhöhlen
oder Gallengängen über die Blutbahn an die Herzklappen, z.B.
nach Zahnextraktionen, Tonsillektomien usw., seltener im Rahmen einer Sepsis
(z.B. septischer Abort). Zu einer Bakteriämie, d.h. dem Eindringen
und Kreisen von Bakterien in die Blutbahn, kann es auch durch andere ärztliche
diagnostische (z.B. Herzkatheter) oder therapeutische Maßnahmen (z.B.
Herzoperationen, Schrittmacherrevision, Hämodialyse) kommen. An den
Klappen finden sich z.T. polypöse, z.T. geschwürige Veränderungen,
weshalb die bakterielle Endokarditis als Endocarditis ulceropolyposa bezeichnet
wird. |
|
Entstehung |
|
|
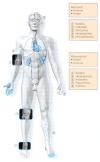
Abb.
14: Symptome bei rheumatischer und bakterieller Endokarditis
|
|
Abb.
14 |
|
|
| Die bakterielle Endokarditis
kann akut und schnell, sehr viel häufiger aber schleichend und langsam
verlaufen. Man spricht daher auch von Endocarditis lenta. Leitsymptome
sind subfebrile Temperaturen, Anämie und ein meist nachweisbarer Herzklappenfehler.
Die Patienten haben ein starkes Krankheitsgefühl, sind blaß
und klagen über Frösteln und Abgeschlagenheit. In 50% der Fälle
treten schmerzhafte, stecknadelkopf- bis linsengroße Mikroembolien
an Fingern und Zehen auf. Die Mikroembolien entstehen durch Verschleppung
infektiösen Materials aus den Herzklappen in die kleinen arteriellen
Blutgefäße. Diese Mikroembolien beweisen, dass es sich um eine
bakterielle Endokarditis handelt. Meistens besteht ein weicher Milztumor,
außerdem kann begleitend eine subakute Glomerulonephritis, die sog.
Löhleinsche Herdnephritis, auftreten. Regelmäßig bestehen
eine Leukozytose mit Linksverschiebung sowie eine erhöhte Blutsenkungsbeschleunigung.
Wichtig ist der Erregernachweis durch Blutkulturen, die am besten während
eines Fieberschubs angelegt werden. Meist sind zum Erregernachweis mehrfache
Blutkulturen notwendig! |
|
Klinisches
Bild |
Besonders wertvoll für
die Diagnose ist der echokardiographische Nachweis der sog. Klappenvegetation,
der als beweisender Befund gilt.
Die Diagnose der Endokarditis
ist dennoch häufig schwierig. Da sie nicht selten verkannt und als
Sepsis unbekannten Ursprungs fehlgedeutet wird, nennt man sie auch das
"Damoklesschwert des Internisten". |
|
Diagnose |
| Bis zur Einführung
des Penicillins in die Klinik um 1940 verlief die Endocarditis lenta fast
immer tödlich. Die Prognose ist heute wesentlich besser geworden. |
|
Therapie |
| Als Standardtherapie gilt
die Behandlung mit 20-30 Mio. IE Penicillin-G-Natrium, verteilt auf 4-6
i. v.-Kurzinfusionen, evtl. kombiniert mit 2-3 x tägl. 80 mg Gentamicin
parenteral. Die Antibiotikaauswahl bei anderen Erregern erfolgt
in Abhängigkeit von der Resistenzbestimmung. Bei akuten, dramatisch
verlaufenden Endokarditiden, z.B. der Aortenklappe und rascher Entwicklung
einer Klappeninsuffizienz, ist der sofortige operative Klappenersatz häufig
die einzige lebensrettende Maßnahme. |
| Bei besonders gefährdeten
Patienten, wie Patienten mit angeborenen oder erworbenen Herzfehlern, Zustand
nach Herzoperationen oder früherer Endokarditis, empfiehlt sich vor
geplanten Zahnextraktionen, Tonsillektomien oder Urogenital- bzw. Darmoperationen
eine Prophylaxe mit Antibiotika in Form einer sog. 2-Dosis-Prophylaxe,
d.h. 1 Dosis 1 Std. vor dem Eingriff, 1 Dosis 6 Std. danach. Bei Tonsillektomien
und Zahnextraktionen werden je 1,2 Mio. IE Penicillin V gegeben, bei chirurgischen
Eingriffen je 2 g Amoxicillin oral oder intravenös. Bei einer bestehenden
Penicillinunverträglichkeit kommen Vancomycin oder Clindamycin in
Frage. |
|
Endokarditis-
prophylaxe |
|
|
(Historisches) Fallbeispiel
3
Der 1860 geborene, später
weltberühmt gewordene Komponist GUSTAV MAHLER erkrankte in der Jugend
an rheumatischem Fieber und litt unter rezidivierenden Mandelentzündungen.
Während einer Amerika-Tournee von 1908 bis 1911 stellten sich die
ersten Symptome einer Herzinsuffizienz ein. Sein behandelnder Arzt stellte
lediglich einen Herzklappenfehler fest. Erst der amerikanische Internist
EMANUEL LIBMAN diagnostizierte 1911 bei MAHLER eine subakute Streptokokkenendokarditis.
Da damals eine antibiotische Behandlung noch nicht möglich war, verstarb
MAHLER an seiner Endokarditis am 18.5.1911. Im übrigen wurde eine
Sonderform der Endokarditis, die Endokarditis bei Lupus erythematodes,
nach LIBMAN benannt (sog. Endokarditis Libman-Sacks). |
|
Fallbeispiel
3
 |
|
|
| nach oben |
 |
|
|
|
|
| 2.3.3.3 Myokarditis |
|
|
| Definition: Eine
Myokarditis ist eine akute oder chronische Entzündung der Herzmuskulatur. |
|
|
|
 |
|
|
Entzündungen des Myokards
können sehr unterschiedliche Ursachen haben:
• rheumatisch
im Rahmen eines akuten rheumatischen Fiebers,
• infektiös
durch Bakterien (Diphtherie, Tuberkulose, Scharlach) oder Viren, insbesondere
Coxsackie-B-Viren, Zytomegalieerreger,
• toxisch,
z.B. im Rahmen einer Urämie,
• idiopathisch,
d.h. ohne erkennbare Ursache. |
|
Ursachen |
| In ausgeprägten Fällen
weisen Herzklopfen, Herzschmerzen, Tachykardie. Rhythmusstörungen,
Herzvergrößerung und Atemnot auf eine Myokarditis hin. Selten
entwickelt sich eine schwere Herzinsuffizienz. Der Übergang in eine
Kardiomyopathie ist in ca. 20% zu beobachten. Am meisten sind die Patienten
durch Herzrhythmusstörungen gefährdet, die unter Umständen
sogar zum plötzlichen Herztod durch Kammerflimmern führen können.
Bei vielen Infektionskrankheiten kann allerdings auch eine meist harmlose,
klinisch kaum auffallende Begleitmyokarditis ablaufen. |
|
Klinisches
Bild |
| Im EKG und in der Echokardiographie
können Veränderungen auftreten, die jedoch nicht spezifisch sind.
Typische, aber ebenfalls nicht beweisende Laborbefunde sind BSG-Beschleunigung,
Leukozytose, Erhöhung von CK und CK-MB. Ihr Fehlen spricht jedoch
nicht gegen eine Myokarditis. Virusserologie und Myokardbiopsien können
zur Diagnosesicherung beitragen. |
|
Diagnose |
| Die Therapie richtet sich
nach der Ursache, d.h. sie erfolgt antirheumatisch, antibiotisch oder mit
Diphtherieserum usw. Bei manifester Herzinsuffizienz sind Herzglykoside
erforderlich. Die Patienten müssen unbedingt strenge Bettruhe
einhalten. AV-Blockierungen können eine passagere Schrittmacherbehandlung
erforderlich machen. Bei gleichzeitig bestehender Herzinsuffizienz ist
zudem eine Antikoagulation erforderlich. |
|
Therapie |
| Die früher zu Recht
gefürchtete Diphtheriemyokarditis mit plötzlichen Todesfällen
ist, wie die Diphtherie selbst, sehr selten geworden. In jüngster
Zeit wurden in Deutschland kleinere Myokarditisepidemien, die durch Coxsackie-Viren
bedingt waren, mit z.T. tödlichem Ausgang beobachtet. Die Mehrzahl
leichterer Myokarditiden heilt folgenlos aus. Dennoch beträgt die
Letalität der Myokarditis durch Herzinsuffizienz, maligne Herzrhythmusstörungen
oder Entwicklung einer Kardiomyopathie in den ersten drei Jahren bis zu
15%. |
|
Prognose |
|
|
| nach oben |
 |
|
|
|
|
| 2.3.3.4 Perikarditis |
|
|
| Definition: Akute
oder chronische Entzündungen des Herzbeutels (Perikard) werden als
Perikarditis bezeichnet. |
|
|
|
 |
|
|
Die Perikarditis kann, ebenso
wie die Myokarditis, auf sehr unterschiedlichen Ursachen beruhen:
| • |
Am häufigsten ist die
idiopathische Perikarditis, deren Ursache ungeklärt ist (viral bedingt?
Autoimmunprozess?) und die meistens innerhalb weniger Wochen folgenlos
abheilt, |
| • |
rheumatisch (ARF), |
| • |
infektiös (Bakterien,
Viren), |
| • |
nichtinfektiös als
Begleitsymptom eines Herzinfarkts oder nach Herzoperationen, |
| • |
Nierenversagen, |
| • |
Herztrauma, |
| • |
Perikarditis mit Perikarderguss
bei Schilddrüsenunterfunktion. |
|
|
Ursachen |
| Geht die Perikarditis ohne
Erguss einher, so wird sie Pericarditis sicca genannt, im Gegensatz zur
Pericarditis exsudativa, bei der sich im Herzbeutel ein Erguss entwickelt,
der mehrere 100 ml bis maximal 1,5 bis 2 l betragen kann. |
Bei der trockenen Perikarditis
stehen Herzschmerzen, die durch das Reiben der entzündeten
Perikardblätter entstehen, im Vordergrund. Dieses Perikardreiben
kann man gelegentlich mit der Hand fühlen; mit dem Stethoskop ist
ein typisches "Lokomotivengeräusch" wahrnehmbar. Die Herzgröße
ist normal.
Beim Perikarderguss
erscheint das Herz im Röntgenbild größer und kann eine
"Tabaksbeutelform" annehmen; die Herztöne werden sehr leise. Am einfachsten
und sichersten gelingt der Nachweis eines Perikardergusses echokardiograpisch.
Das EKG zeigt bei Perikarditis häufig sehr charakteristische Veränderungen.
Ist der Erguss ausgedehnter, so führt er in der Diastole zu einer
Behinderung des Bluteinstroms. Daraus resultiert ein Aufstau des Blutes
vor dem Herzen. Diese Einflussstauung wird durch dicke, gestaute Venen
am Hals und im Bereich des Brustkorbs erkennbar; Stauungsleber, Beinödeme
und Aszites können hinzutreten. Treten z.B. nach Verletzungen des
Herzens oder nach Herzwandrissen im Rahmen eines Herzinfarkts größere
Blutmengen in den Herzbeutel über, so entsteht ein Hämatoperikard. |
|
Klinisches
Bild |
| Die Therapie der Perikarditis
richtet sich nach der Ursache, d.h. sie erfolgt antirheumatisch, antibiotisch
oder tuberkulostatisch. Ausgedehnte Perikardergüsse führen zu
einer so genannnten Herzbeuteltamponade; da diese lebensbedrohlich
ist, muss rasch eine entlastende Perikardpunktion unter echokardiographischer
Kontrolle durchgeführt werden. Bei chronischen Perikardergüssen
kann durch operative Maßnahmen, z.B. durch eine "Perikardfensterung",
eine Ergussableitung erzielt werden. |
|
Therapie |
|
|
| 2.3.3.5
Pericarditis constrictiva |
|
| Eine schwerwiegende Folgeerscheinung
der Perikarditis ist die Pericarditis constrictiva. Im Rahmen einer akuten
Perikarditis kann sich eine bindegewebige Umwandlung des Perikards bis
zur völligen Umschwielung und Verschwartung des Herzbeutels
entwickeln. Diese Sonderform der Perikarditis, die Pericarditis constrictiva,
behindert Systole und Diastole des Herzens. Die Folgen sind ein venöser
Rückstau vor dem Herzen und eine ungenügende Auswurfleistung
des Herzens selbst. Meist stehen die Zeichen der Stauung im großen
Kreislauf im Vordergrund. Sind die Perikardschwielen verkalkt, so spricht
man von einem Panzerherz. Erfolgversprechend ist nur die chirurgische Behandlung,
d.h. das Herz wird operativ von seinem Panzer befreit (Perikardektomie). |
|
Komplikationen |
| nach oben |
 |
| vorige Seite |
 |
| nächste Seite |
 |
|
|
Linus
Geisler: INNERE MEDIZIN. 17. vollständig überarbeitete und erweiterte
Auflage, Stuttgart Berlin Köln
|
| ©
1969/1999 W. Kohlhammer Verlag |
| Autorisierte
Online-Veröffentlichung: Homepage Linus Geisler - www.linus-geisler.de |
|